直線性試験の続きです。
正しく測れていれば、グラフはまっすぐになる筈ですが、
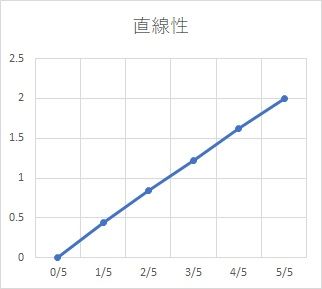
曲がっている場合はどんな場合でしょうか?
これには2パターンあります。
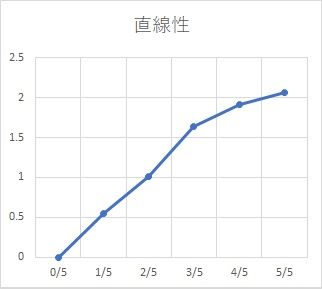
まずは上向きの弧を描いている場合。良くあるケースです。
・血清干渉を受けている
・検量線が曲がりすぎている
(検体と標準物質の挙動が合っていない)
・反応時間が足りない
・標識の濃度が足りない
・酵素反応量が追いついていない
等々。たくさんの原因が考えられます。
色んな濃度の検体で試験してみて、
・特定の検体で起こる
→ 検体固有の血清干渉(反応を抑制する物質がある)
・どんな濃度の検体でも起こる
→ 試薬組成の問題(血清干渉を防ぎ切れていない)
・高濃度でだけ起こる
→ 何らかの試薬成分が飽和(Saturation)を起こしている
と考えていきます。
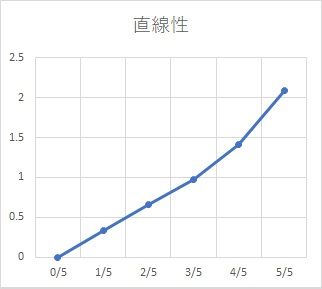
次に下向きの弧を描く場合。このケースはそんなに多くないです。
・血清干渉を受けている
・検量線が伸びすぎている
(検体と標準物質の挙動が合っていない)
抗原抗体反応を促進させる物質が検体に含まれている、などの原因が考えられます。
このように、直線性試験(希釈試験)は簡単にできる試験にもかかわらず、問題の解決に向けた色々な手がかりを与えてくれます。
データがおかしいなと感じたら、真っ先に実施する試験としてお勧めです。
