それでは酵素標識抗体を作ります。
二価性の架橋剤(hetero-bifunctional crosslinker)といって、2種類のアミノ酸側鎖を結合するような化学物質を使います。
代表的なEMCSやGMBSは片方にスクシニミド基、片方にマレイミド基を持っており、スクシニミド基はアミノ基に、マレイミド基はSH基に結合します。
具体的なプロトコルはこちらを参照。
PODもALPも同じ方法でできるけど、ここではプロトコル通りALPとEMCSを使った方法で説明します。
まずはALP上のアミノ基にEMCSを結合させて、ALPにマレイミド基を導入しましょう。
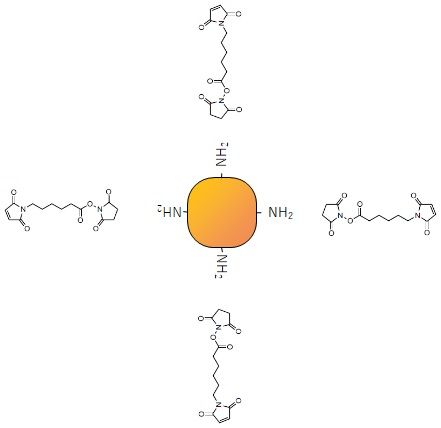
①ALPを用意
市販のALPを2mgぐらい用意します。
ALPを使う時には1mM MgCl2と0.1mM ZnCl2をバッファーに入れておくと安定です。バッファーはもちろんリン酸以外で。
②50mM EMCS溶液を用意
EMCSを耳かきみたいな薬さじで一かき、エッペンドルフチューブに入れます。この時電子天秤で重さを量りながら入れましょう。
EMCSの重量から、15.4mg/mLになるような液量を計算します。
チューブにその液量のDMF(ジメチルホルムアミド)を入れてEMCSを溶解します。
③ALPにEMCS溶液を添加
ALPにモル比で40倍ぐらいになるようなEMCSを添加します。
ALP 2mg=13.3nmolですから、13.3×40=532nmol、この量に相当する50mM EMCS 10.6μLを添加します。
よく撹拌して30℃、30分インキュベートします。
④結合しなかったEMCSを脱塩除去
インキュベートした混合液をPD-10で脱塩します。
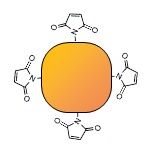 これでマレイミド基を導入したALPが完成。
これでマレイミド基を導入したALPが完成。
次回に続きます。
タンパク質はmgで扱うのに、なぜかこういう計算にはmolを使っています。
そういう習慣なんですけど、どっちかに統一すればいいのに。何か焦れったいですね。
あと、この段階でマレイミド基の定量を行うと、だいたいALP1分子に3~4個入ります。PODだと1~2個ぐらいです。
二価性の架橋剤(hetero-bifunctional crosslinker)といって、2種類のアミノ酸側鎖を結合するような化学物質を使います。
代表的なEMCSやGMBSは片方にスクシニミド基、片方にマレイミド基を持っており、スクシニミド基はアミノ基に、マレイミド基はSH基に結合します。
具体的なプロトコルはこちらを参照。
PODもALPも同じ方法でできるけど、ここではプロトコル通りALPとEMCSを使った方法で説明します。
まずはALP上のアミノ基にEMCSを結合させて、ALPにマレイミド基を導入しましょう。

①ALPを用意
市販のALPを2mgぐらい用意します。
ALPを使う時には1mM MgCl2と0.1mM ZnCl2をバッファーに入れておくと安定です。バッファーはもちろんリン酸以外で。
②50mM EMCS溶液を用意
EMCSを耳かきみたいな薬さじで一かき、エッペンドルフチューブに入れます。この時電子天秤で重さを量りながら入れましょう。
EMCSの重量から、15.4mg/mLになるような液量を計算します。
チューブにその液量のDMF(ジメチルホルムアミド)を入れてEMCSを溶解します。
③ALPにEMCS溶液を添加
ALPにモル比で40倍ぐらいになるようなEMCSを添加します。
ALP 2mg=13.3nmolですから、13.3×40=532nmol、この量に相当する50mM EMCS 10.6μLを添加します。
よく撹拌して30℃、30分インキュベートします。
④結合しなかったEMCSを脱塩除去
インキュベートした混合液をPD-10で脱塩します。

次回に続きます。
タンパク質はmgで扱うのに、なぜかこういう計算にはmolを使っています。
そういう習慣なんですけど、どっちかに統一すればいいのに。何か焦れったいですね。
あと、この段階でマレイミド基の定量を行うと、だいたいALP1分子に3~4個入ります。PODだと1~2個ぐらいです。